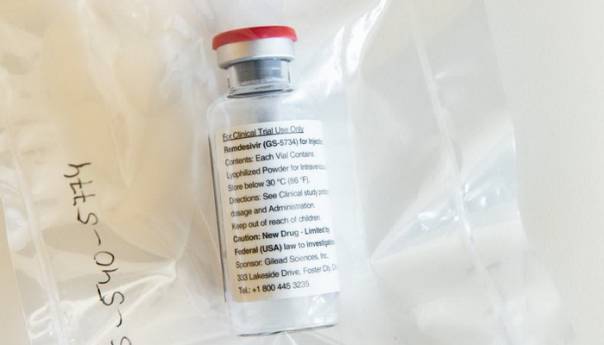
Američka agencija za hranu i lijekove (FDA) odobrila je u petak izvanrednu primjenu lijeka remdesivir u tretmanu pacijenata sa težim oblikom bolesti Covid-19, javlja CNN.
FDA je izdala odobrenje na osnovu dijela rezultata testiranja kojeg je sponzorisao Nacionalni institut za zdravlje, rezultata koje je u srijedu objavio dr. Anthony Fauci. Ubrizgavanje lijeka je smanjilo trajanje bolesti kod nekih teže oboljelih pacijenata.
Izvanredno odobrenje je na kontrolnoj skali pozicionirano ispod punog odobrenja kojeg izdaje FDA, ali to također znači da agencija vjeruje kako korist ovog lijeka prevazilazi rizike kod nekih pacijenata, prenosi N1.
Direktor kompanije Gilead Sciences, proizvođača remdesivira sa sjedištem u Kaliforniji, rekao je u otvorenom pismu prije dva dana kako trenutna opskrba s ovim lijekom može pokriti najmanje 140.000 tretmana kod pacijenata koji se liječe od Covid-19 bolesti.
N1 podsjeća, da su krajem prošlog mjeseca svjetski mediji premijeli kako se remdesivir nije pokazao kao uspješan u liječenju bolesti izazvane novim koronavirusom.
Kinesko istraživanje pokazalo je da lijek nije bio uspješan, prema nacrtima dokumenata koje je slučajno objavila Svjetska zdravstvena organizacija (WHO), prenio je BBC.
– Lijek nije poboljšao stanje pacijenata ili smanjio prisustvo patogena u krvi- rečeno je.
Remdesivir je lijek koji je ranije testiran za liječenje ebole, no nije se pokazao učinkovitim. On djeluje direktno na virus tako što ‘glumi’ jedan od ‘građevnih’ elemenata RNK i DNK i ulazi u genom virusa te blokira njegovo razmnožavanje.
Dosadašnja istraživanja tog lijeka koji se daje intravenski, među kojima i ono provedeno u Wuhanu, pokazala su kontradiktorne rezultate.
Po istraživanju na malom uzorku od 237 ispitanika u Wuhanu lijek se nije pokazao djelotvornim osim u slučaju pacijenata na respiratorima, objavljeno je u časopisu Lancet.
To je istraživanje, u kojem je bila i kontrolna grupa, na kraju prekinuto zbog toga što se po mnogim stručnjacima odvijalo uz premali broj ispitanika da bi rezultati bili pouzdani.